زیست شناسی
مطالب زیست شناسیزیست شناسی
مطالب زیست شناسیمغز در بکارگیری مناطق مختلف خود برای درک حواس ، بیش از تصور ما ا
نابینایان مادرزاد از بخش مربوط به بینایی مغز خود که دیگر در بینایی استفاده نمی شود، استفاده دقیق تری می نماید ..
پژوهشگران علوم پزشکی می گویند نتایج جدیدتری تحقیقاننشان می دهد که نابینایان مادرزاد برای بهبود حس لامسه و شنوایی، بخشی از مغز خود را به کار می گیرند که معمولا در هنگام دیدن مورد استفاده قرارمیگیرد.

به گزارش خبرنگار زیست گام به نقل از یونایتدپرس ، دانشمندان
آمریکایی در پژوهش های خود در بخش عصب شناسی ‘مرکز پزشکی دانشگاه جورج
تاون’ اعلام کردند بررسی های آنها نشان می دهد که چرا افرادی که قادر به
دیدن نیستند از چنان میزان پیشرفته ای از درک این حواس و توانایی ها
برخوردار هستند که بسیار فراتر از درک افرادی است که می توانند ببینند.
در این بررسی این طور مطرح می شود که شاخصه های کاربردی مختلفی که بینایی
را ممکن می سازد مثل تحلیل فضا، الگوها و حرکت همچنان در کورتکس بینایی
افراد نابینا وجود دارد.
اما شخص نابینا به جای استفاده از این مناطق برای تجزیه و تحلیل آنچه که
چشم می بیند از آنها برای پردازش آنچه به گوش آنها می رسد و یا آنها را لمس
می کنند دست می زند زیرا برای همین اجزاء برای تحلیل اطلاعات رسیده از
حواس لازم است.
‘جوزف پی راشکر’ یکی از پروفسورهای بخش فیزیولوژی و بیوفیزیک وابسته این به
دانشگاه گفت: ما می بینیم که قسمت اعظم کورتکس بینایی فرد نابینا هنگامیکه
در حال شنیدن و لمس کردن است روشن می شود. این فرآیند البته غیر از عملکرد
مناطقی از مغز است که اختصاص به پردازش صدا و لمس اشیاء دارد.
این عملکرد نشان می دهد که سیستم بینایی در افراد نابینا نظم کاربردی را که
ژنتیک از طریق آناتومی در اختیار ما گذارده است حفظ می کند واینکه مغز هم
برای استفاده از این مدول ها ( modules ) جهت تحلیل داده های رسیده از
حواس به قدر کافی انعطاف پذیری دارد.
سلول های عصبی و فیبرهای مربوط به این سیستم هنوز در آنجا قرارداشته و فعال
و در حال پردازش شاخصه های تخیلی انگیزه هایی هستند که عامل آنها نه
بینایی بلکه شنوایی و لامسه است.
نتایج پژوهشها نشان می دهد که یک پروتئین کلیدی قادر به بازسازی سل
پژوهشگران علوم پزشکی در دانشگاه پنسیلوانیای آمریکا در طی یک کشف غیر منتظره مشاهده کردند که در کنار یک آسیب دیدگی شدید سلولهای عصبی یک پروتئین کلیدی قادر به بازسازی این سلولها است.
به گزارش خبرنگار سایت زیست گام ، دکتر ملیسا رولز استادیار بیوشیمی و میکروبیولوژی در پن استیت در ژورنال کورنت بیولوژی اظهار کرد: محققان امیدوارند که کشفشان به رفتارهای جدیدی در زمینه بیماریهاو آسیب دیدگیهای عصبی کمک کند.
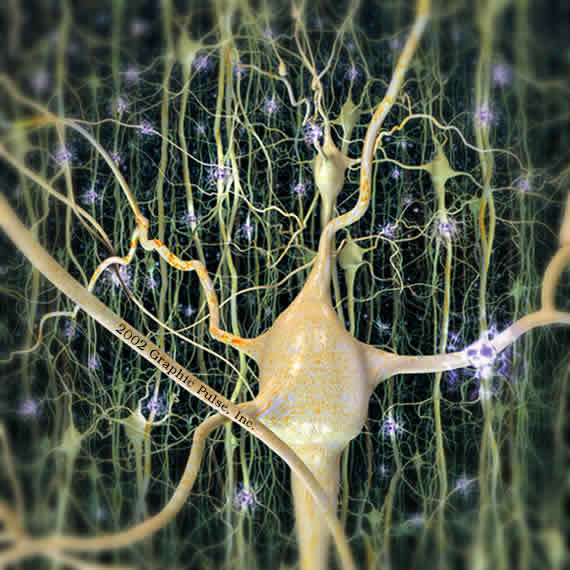
پس از بررسیهای رولز و همکارانش در یک بیانیه مطبوعاتی اظهار کردند که پس از بررسی شاخه های متعدد سلولهای عصبی به شباهت بسیار کم آنها با آکسون ها دست یافتند.
نورونها شبیه سلولهای دیگر در یک غشای سلولی احاطه شده اند که شامل هسته، سیتوپلاسم، میتوکندری و سایر اندامکها هستند و آنها پروتئین و انرژی می سازند.
اما آنها در چگونگی برقراری ارتباط متفاوت می باشند و ساختار آنها به گونه ای است که یک سیگنال مشخصی را برای بدن می فرستد و پس از پایان عمر آنها سلولهای جدید جایگزین آنها می شوند.
برای برقراری ارتباط، نورونها از دونوع خاص اسلحه که شاخه های سلولهای عصبی و آکسون ها که پروژه را در جهت مخالف سلولهای بدن هدایت می کند استفاده می کنند.
آکسونها اطلاعات را به دور از سلولهای بدن ،به سطوح صاف می برد و عمدتا فقط یک آکسون در هر سلول وجود دارد.
آنها می توانند کوتاه و یا بلند باشند و یا شاخه ای باشند که شاخه ها تمایل دارند در نقاط دور از بدن باشند.
برخلاف آکسون ها که شکل بزرگ دارند و با نرم افزار قابل تشخیص است،شاخه های سلولهای عصبی بسیار عمیق و غیر قابل تشخیص هستند.
برای حل این مشکل او و تیمش از یک موجود ساده بنام مگس میوه که سلولهای عصبیش بسیار شبیه انسان است استفاده کردند.
هرچند که بین آکسون و سلولهای عصبی تفاوت وجود دارد اما شباهتشان به این است که هردو حاوی میکروتیوبلس هستند که در امتداد طول خود کارهای مختلفی نظیر حمل و نقل مواد خام به مناطق دور از سلول و تعیین شکل سلول انجام می دهند.
میکروتیوبلس ها ی توصیفی رولز بعنوان “بزرگراه” ویژگی جالبی دارند که در عین حال که استوانه شکل هستند ولی متقارن نمی باشند.و این زمانی جالبتر می شود که آکسون ها در نقاط میکروتیوبلس ها در یک مسیر متفاوت به شاخه های سلولهای عصبی می رسند.
یک انتقال دهنده عصبی کشف شده که موجب افزایش یادگیری و حافظه می ش
محققین در رشته نورولوژی در کشور انگلیس با هدف یافتن راهی برای درمان نقص حافظه در بیماران مبتلا به آلزایمر موفق شدند یک ماده شیمیایی را در مغز کشف کنند که با توانایی ذاتی مغز در یادگیری و حافظه ارتباط دارد.
به گزارش خبرنگار سایت زیست گام ، نتایج این تحقیقات نشان می دهد که یک انتقال دهنده عصبی موجب افزایش یادگیری و حافظه می شود. و این کشف محققان دانشگاه بریستول می تواند در معالجه افراد آسیب دیده از آلزایمر کاربرد داشته باشد.

در حال حاضر تنها درمان موثر برای علائم کاهش شناختی در آلزایمر استفاده از داروهایی است که ترشح ماده “استیل کولین” را افزایش داده و موجب بهبود تواناییهای حافظه بیمار می شود.
استیل کولین در مدت یادگیری در مغز ترشح می شود و برای تهیه و جمع آوری خاطرات جدید نقش کلیدی ایفا می کند.
نقش این ماده در افزایش فعالیت گیرنده هایی به نام NMDA است. این گیرنده ها پروتئینهایی هستند که شدت اتصال میان نورونها را کنترل می کنند.
این نورولوژیستها مکانیزیمی را کشف کردند که استیل کولین از طریق آن عملکرد گیرنده های NMDA را سازماندهی می کند.
در این مکانیزم، استیل کولین مانع فعالیت پروتئینهای دیگری به نام به نام “کانالهای SK” می شود. این کانالها به طور طبیعی فعالیتهای گیرنده های خود را کاهش می دهند.
کشف عملکرد کانالهای “SK” اطلاعات جدیدی را درباره مکانیزمهایی ارائه می کند که بر تواناییهای شناختی نظارت دارند. همچنین می تواند راه جدیدی در توسعه داروهایی که توانایی متوقف کردن فعالیت این کانالها را دارند ارائه کند.
جک ملور سرپرست این تیم تحقیقاتی در این خصوص اظهار داشت: “از دیدگاه درمانی، نتایج این تحقیقات نشان می دهد بعضی از داروهایی که بر روی گیرنده های ویژه استیل کولین اثر می گذارند می توانند فواید بسیاری در درمان اختلالات شناختی داشته باشند.
ما نشان دادیم که چگونه با استفاده از اثرات استیل کولین بر روی گیرنده های خاص می توان اتصالات میان نورونها را تقویت کرد.
این کشف می تواند برای بیمارانی که از بیماریهای چون آلزایمر و اسکیزوفرنی رنج می برند بسیار مفید باشد.
نتایج این تحقیقات در مجله علمی نورون منتشر شده است .
ممکن است ” ترافیک اطلاعاتی در مغز” عامل بروز میگرن باشد
پژوهشگران می گویند “ ترافیک اطلاعاتی ” عامل میگرن در مغز است .
یک تیم بینالمللی از پژوهشگران ژنتیک، ژنی کشف کردند که نقص عملکرد آن موجب بروز سردردهای میگرنی متداول میشود. این ژن فعالیت پروتئینی را کنترل میکند که وظیفه آن برطرف کردن ترافیکهای اطلاعاتی در مغز است.
----------------------------------------------------------------------
به گزارش خبرنگار سایت زیست گام ، تیم “آرنو پالتوی” از انیستیتو Wellcome Trust Sanger بریتانیا در تازهترین شماره مجله تخصصی “طبیعت ژنتیک” مقالهای منتشر کرده که نتیجه تحقیقات گسترده این تیم در مورد سردردهای متداول میگرنی است.
این تیم ژنی کشف کرده است که عملکرد ناقص آن موجب بروز سردردهای میگرنی میشود. تا کنون تحقیقات مختلفی در مورد تأثیر ژنها در بروز سردردهای میگرنی صورت گرفته است. البته بخش عمده این تحقیقات به سردردهای نادر و شدید مربوط میشود.
تیم آرنو پالتوی برای نخستین بار در مورد سردردهای متداول میگرنی تحقیق کرده است. دکتر پالتوی خود میگوید: «برای نخسیتن بار موفق شدیم مجموعه ژنوم هزاران انسان را با دقت کامل بررسی کنیم.
در این تحقیق فعالیت ژنها و اثر آنها را بر سردردهای متداول میگرنی را پیگیری کردیم و به نتایج جالبی رسیدیم.»
مولکولهای RNA شرطی شده ، راه جدید برای مبارزه با سرطانها است
پژوهشگران موسسه تکنولوژی کالیفرنیا پس از دستیابی به این نتایج، مولکولهای کوچک RNA شرطی شده ای را ایجاد کردند که می توانند راه جدیدی در مبارزه با سرطانها را ارائه کنند.
---------------------------------------------------
به گزارش خبرنگار سایت زیست گام به نقل از ساینتیست ، علت اصلی بروز عوارض جانبی داروهای شیمی درمانی این است که این داروها به اندازه کافی گزینشی و انتخابی نیستند و بنابراین علاوه بر سلولهای سرطانی بسیاری از سلولهای سالم و به خصوص سلولهای درحال تکثیر را نابود می کنند.
این دانشمندان در این خصوص توضیح دادند: اگر به درمان سرطان همانند یک برنامه رایانه ای نگاه کنیم می توانیم آغاز عملکرد درمانی را در سطح سلولی تصور کنیم. درصورتیکه یک جهش ژنتیکی مناسب وجود داشته باشد برنامه درمانی اجرا می شود.
در این راستا، این محققان مولکولهایی را در سطح لابراتواری ایجاد کردند که قادرند این وظیفه انتخابی/ گزینشی را در مقابل سلولهای توموری اشکال مختلف سرطان مغز، پروستات و استخوان انجام دهند.
پژوهشگران آمریکایی افزودند: این مولکولها قادرند یک جهش را در داخل سلولهای توموری ایجاد کنند. با این جهش، پاسخ به درمان در سلولهای سرطانی فعال می شود و در عوض سلولهای سالمی که در آنها این جهش ایجاد نشده است نسبت به داروهای شیمی درمانی بدون واکنش می مانند.
در حقیقت مولکولهای کوچک RNA شرطی شده می توانند سلولهای سرطانی را برای پاسخگویی نسبت به درمان آماده و در آنها مکانیزم خود نابود کنندگی را تحریک کنند.
در این درمان از دو RNA کوچک مختلف استفاده شد که هر دو بسیار شبیه به مولکولهای RNA هستند که به طور طبیعی در سلولها حضور دارند و عملکردهای مختلفی را انجام می دهند.
RNA کوچک اول تنها زمانیکه با یک جهش ژنتیکی سرطانزا مواجه شد خود را باز کرد. این علامت به RNA دوم اجازه داد که به RNA اول وصل شود و هر دو زنجیره ای از یک سری واکنشهایی را تشکیل دهند و در این واکنشها برای تشکیل یک زنجیره طولانی تر به زیاد شدن ادامه دهند.
به این ترتیب مکانیزم خود- نابودکنندگی سلولهای سرطانی فعال شد و این سلولها بدون اینکه به سلولهای سالم آسیب وارد شود نابود شدند.